冷冻保存是一种通过防止或最小化损伤来保持细胞和组织的结构和功能的技术。冷冻保存的细胞和组织可以在极低温度下在有限的空间内长期储存,并且需要较少的维护[ 1 ]。干细胞用于移植和基于细胞的治疗,这使得这些细胞成为再生和生物医学研究的有前途的工具。然而,干细胞具有有限的寿命[ 2 ],并与增加的通道的数量,它们的增殖能力和分化降低[ 3,4]。胚胎干(ES)细胞来源于胚泡期胚胎的内细胞团,具有自我更新和分化成不同细胞谱系的潜力[ 5 ]。小鼠ES细胞用于各种研究应用,包括基因打靶,这有助于生成靶标突变小鼠模型,用于功能基因组研究和应用[ 6 ]。从供体小鼠分离的精原干细胞(SSCs)在受体小鼠睾丸中重新繁殖并产生成熟的精子[ 7]]。ES细胞和SSCs在低温保存时的增殖和分化能力的维持可以扩展其在由于化学疗法和放射疗法的性腺毒性作用而导致不育的癌症患者中的再生疗法和恢复生育力的应用[ 6 ]。
几种不同来源的已建立的细胞系通常用于药物测定和基因表达分析[ 8 ]。各种原代细胞也常规用于生物学研究。小鼠胚胎成纤维细胞(MEF)细胞用作饲养细胞来维持的ES细胞和诱导的多能干(iPS)细胞的未分化状态[ 9,10 ]。外周血单核细胞(PBMCs)通常用于广泛的传染病和临床疫苗研究中的前瞻性表型和功能分析[ 11 ]。PBMC用于开发有效的人类免疫缺陷病毒1疫苗并推断效应功能和细胞或体液免疫应答[ 12]。小鼠骨髓细胞(mBMCs)被用于研究血管生成抑制剂的药物在癌症治疗[ 13,14 ]。这些细胞在造血干细胞移植研究[ 15 ]和再生医学[ 16 ]中具有潜在的应用价值。每种细胞类型的结构和细胞膜组成不同,因为它们对冷冻保存的反应不同。冷冻和培养过程中的培养年龄也可能影响冷冻成功[ 17 ]。目前,细胞培养方法应用于生物学和医学的各个领域的广泛增加强调了对无污染和有效细胞冷冻保存的需求。
在冷冻保存期间,细胞损伤主要发生在作为重要细胞成分的水在超低温下冻结时。通过添加冷冻保护剂(CPA)可以最小化细胞损伤。二甲基亚砜(DMSO)由于其低毒性而在细胞和组织冷冻保存中被广泛使用的可渗透的CPA [ 18 ]。胎牛血清(FBS)是一种常用的非渗透性CPA,它与DMSO结合用于几种细胞系和组织,因为它支持更好的细胞恢复。然而,需要找到FBS作为冷冻保存剂的替代品,因为它很昂贵。此外,收集血液的方法是不人道的,因为在屠宰期间通过心脏穿刺从怀孕的牛中取出的牛胎儿采集FBS而不进行任何麻醉[19,20 ]。动物血清的使用还与病毒[ 21 ]和朊病毒污染以及可能的疾病传播[ 22 ] 的风险相关,其中一些不可能从血清中去除。一些这些感染剂,如细菌和病毒,甚至能够在被常规地用于细胞原液存储低温存活的(-160℃)[ 23,24 ]。尽管FBS在生物医学研究中是不可或缺的,但无FBS的cryomedia将通过符合良好的实验室实践而使研究人员受益。
已经考虑了几种低温血清替代品。丝胶蛋白是一种富含丝氨酸的蛋白质水解产物,在脱胶过程中从生丝中获得。已显示丝胶蛋白在大肠杆菌中的表达可预防冷冻应激并促进细胞活力[ 25 ]。含有丝胶蛋白冷冻保存的中国仓鼠卵巢(CHO)和P3UI骨髓瘤细胞的培养基与传统的含FBS培养基一样有效,并优于几种商业无血清冷冻培养基[ 26 ]。同样,在低温介质中用牛血清白蛋白(BSA)替代FBS显示细胞恢复和外周血单核细胞活力无显着差异[ 27]。然而,丝胶蛋白和BSA的极高成本限制了它们的使用,特别是在发展中国家。
单独使用牛眼液(BOF)以及与绵羊血浆和人血清白蛋白的组合已被评估为不同细胞的血清替代物[ 28 ]。BOF有几种促进细胞生长的活性成分,如血管内皮生长因子[ 29 ],21-KDa酸性钙结合蛋白[ 30 ],胰岛素样生长因子,次黄嘌呤和纤维连接蛋白[ 31 ]; 但是,它本身不支持细胞生长。此外,眼液中含有多种蛋白质,包括白蛋白[ 32],可以作为非渗透性注册会计师。收集水牛眼液(BuOF)在印度是可行的,因为没有关于水牛屠宰的宗教禁忌,并且水牛眼可作为屠宰场副产品大量供应。BuOF的价格比FBS的价格低7-8倍(在印度情景中),因为眼睛是封闭的器官,因此无法收集BuOF。然而,迄今尚未评估BuOF对细胞冷冻保存的影响。
本研究的目的是评估BuOF是否可以代替FBS进行细胞冷冻保存。我们还评估了BuOF的组成,以确定可能在赋予冷冻保护能力方面起关键作用的组分。
去:
所有动物程序均由印度海德拉巴的细胞和分子生物学中心(CCMB)的动物伦理委员会(IAEC)批准。从印度海德拉巴市的Slaughter House收集来自健康Murrah雄性小牛(n = 12;年龄,6-8个月)的完整眼球,并在冰上用磷酸盐缓冲盐水(PBS; Invitrogen)转运。在屠宰后1小时内到达实验室后,从眼球中修剪出眼肌和视神经。用冰冷的50%乙醇和PBS冲洗几次后,用22号针头小心地刺破眼球的角膜,并收集房水。然后使用无菌手术刀切开眼球的后房,并使用10-ml注射器收集玻璃体液。g(在4℃下15分钟),然后通过0.45-μm和0.22-μm过滤器过滤。将无菌BuOF等分到冷冻管(Nunc)中并在-30℃下储存直至使用。
BuOF和FBS的生化组成的差异由医学诊断机构(Vijaya Diagnostics; www.vijayadiagnostic.com)确定。每个用于FBS(Gibco;来源,美国;批号;分别为494515,816712和835987)和合并的BuOF的总共三个样品用于分析。每种分析的生物化学的平均值和用于分析的方法列于表1中。
BuOF和FBS的比较生化分析。
参数(mg / dl) | 用于分析的方法 | BuOF | FBS | |
1 | 总蛋白质 | 双缩脲 | 0.5±0.03 | 3.25±0.23 |
2 | 白蛋白 | 溴甲酚绿(BCG) | 0.2±0.09 | 1.85±0.32 |
3 | 球蛋白 | Biuret和BCG | 0.3±0.01 | 1.4±0.2 |
4 | 脂蛋白A. | 粒子增强免疫比浊法 | 1.8±0.1 | 2.5±0.2 |
五 | 甘油三酯 | 甘油-3-磷酸氧化酶 - 苯酚氨基苯醌(GPO-PAP)比色法 | 13±0.9 | 61±1.4 |
6 | 总胆固醇 | (胆固醇氧化酶 - 过氧化物酶)同位素稀释(CHO-POD)IDMS质谱 | 22.5±1 | 27.5±1.02 |
7 | 低密度脂蛋白胆固醇 | 酶促免疫抑制 | 14±0.9 | 8±0.8 |
8 | HDL胆固醇 | (总胆固醇) - (HDL + VLDL胆固醇) | 6±0.7 | 8±0.6 |
9 | VLDL胆固醇 | (TG / 5) | 2.6±0.5 | 12.5±0.8 |
10 | 葡萄糖 | 己糖激酶 | 56.5±2.3 | 77±4.1 |
11 | 抗坏血酸 | 分光光度法 | 7.27±0.7 | 1.13±0.2 |
值以平均值±SEM表示。
IAEC批准从小鼠中获得细胞(许可证号为IAEC 52/2014和4/2015)。为了分离人外周血单核细胞(hPBMC),获得了印度海得拉巴CCMB的机构伦理委员会(IEC)的批准(许可证号为IEC 35/2015)。除非另有说明,否则所有试剂均购自Invitrogen。细胞系包括中国仓鼠卵巢细胞(CHO-K1ATCC,CCL-61),小鼠胚胎干(mES)细胞-R1(ATCC,SCRC-1011)和人胚肾细胞(HEK-293T / 17ATCC,CRL-11268)购自美国典型培养物保藏中心(ATCC)。永生化C18-4小鼠A型精原细胞系[ 33]是Marie-Claude Hofmann博士(德克萨斯大学MD安德森癌症中心,美国德克萨斯州休斯顿)的礼物。在获得书面同意后,如前所述[ 27 ]从任一性别的健康志愿者收集的血液中分离人PBMC (n = 9)。如前所述,MEF细胞[ 34 ]和mBMCs [ 35 ]均来自C57BL / 6小鼠(n = 6)。所有贴壁细胞在具有高葡萄糖和悬浮细胞的Dulbecco改良的Eagle培养基(DMEM)中在Roswell Park Memorial Institute(RPMI)1640培养基中培养。两种培养基均补充10%热灭活的FBS,1×非必需氨基酸溶液和1×抗生素 - 抗真菌溶液,细胞在5%CO 2中培养。环境温度为37°C。培养24小时后新鲜的融合贴壁细胞和72小时培养后的新鲜悬浮细胞被认为是对照组。
不受控制的慢速冷冻方案用于细胞冷冻保存。用于冷冻的Cryomedia由DMEM / F12-HEPES组成,其仅含有10%DMSO(Sigma)(D10)和20%FBS(v / v)(D10S20)或20%BuOF(v / v)(D10O20)。在每个2ml冷冻管中,将细胞悬浮液(1×10 7个细胞)加入1ml低温培养基中并在冰上平衡30分钟。将冷冻管置于异丙醇容器(Mr.Frosty Freezing Container; Thermo Scientific)中并保存在-80℃冰箱(Thermo Scientific)中。按照制造商的方案,以约1℃/ min的不受控制的速率冷却细胞。24小时后,将冷冻管转移至液氮中储存。
1个月后,通过将冷冻管在37℃水浴中旋转直至内容物完全熔化来解冻细胞。将解冻的内容物转移到含有10ml补充有10%FBS的DMEM / F12-HEPES的15ml管中。轻轻混合试管中的内容物,以200× g离心5分钟,并将细胞沉淀物悬浮于DMEM /高葡萄糖或含有10%FBS的RPMI 1640培养基中,这取决于细胞类型。在接种培养细胞之前测定细胞活力。
在解冻后和培养24小时(贴壁细胞)和72小时培养(悬浮细胞)后立即评估细胞活力。通过台盼蓝染料(Sigma)排除分析测定细胞活力。在孵育结束后不迟于10分钟进行显微镜评估。计数约500个细胞/组用于细胞活力分析。
对于细胞回收测定,根据每组中的解冻后存活率接种细胞。使用上述培养基和培养条件,以2×10 5活细胞/ cm 2的密度,在100-mm培养皿和悬浮细胞中,在75-mm 2培养瓶(均来自TPP)中培养贴壁细胞。24小时后,用PBS洗涤粘附的细胞两次,并通过胰蛋白酶(0.25%)消化收获细胞。培养72小时后,通过以200× g沉淀5分钟收集悬浮细胞。评估回收的细胞的存活率并计数以估计每个冷冻保存组中的细胞恢复[ 27 ]。
将培养24小时的冷冻解冻的贴壁细胞和培养72小时的悬浮细胞评估凋亡和细胞增殖特异性蛋白的表达。通过在溶解缓冲液(7M尿素,2M硫脲,4%CHAPS [3 - [(3-胆酰胺丙基)二甲基氨基] -1-丙磺酸盐],18mM Tris-HCl,14mM Tris-Base,0.2中超声处理均质化提取总蛋白质。 %Triton-X和50mM二硫苏糖醇)。在蛋白质提取之前,将单一强度的ProteCEASE-50(一种不含乙二胺四乙酸(EDTA)的蛋白酶抑制剂(G-Biosciences))加入到溶解缓冲液中。将裂解的样品(30μg)进行12%十二烷基硫酸钠(SDS) - 聚丙烯酰胺凝胶电泳(PAGE)。将凝胶转移到聚偏二氟乙烯(PVDF)膜(Millipore)上。用起始块(TBS)封闭缓冲液(Life Technologies)在室温下封闭膜1小时。所有一抗和二抗均购自Thermo Scientific,无论是否另有说明。将封闭的膜与下列一抗孵育,以评估早期凋亡蛋白Annexin V,1:1000(Santa Cruz Biotechnology)的表达; 细胞增殖蛋白,增殖细胞核抗原(PCNA),1:1000; 促凋亡蛋白,BCL2相关X蛋白(BAX),1:200; 和抗凋亡蛋白,B细胞淋巴瘤2(BCL2),1:1000。为了控制凝胶上的蛋白质负载,用甘油醛-3-磷酸脱氢酶(GAPDH),1:1000抗体探测膜。然后用TBS-T洗涤膜,并在山羊抗小鼠或山羊抗兔HRP-缀合的二抗(1:10000)在TBS中在室温下孵育1小时。在用TBS-T洗涤后,使用针对Super Signal West Femto化学发光底物(Thermo Scientific)的C-DiGit印迹扫描仪(Licor)通过化学发光揭示免疫反应性,并使用光密度计分析产生的信号。对于每个冷冻保存组,将来自每种抗体的信号标准化为GAPDH的信号。
使用溶解缓冲液(7M尿素,2M硫脲,4%CHAPS,18mM Trizma碱,2片EDTA蛋白酶抑制剂,0.2%Triton X和50mM DTT)提取来自BuOF和FBS样品的总蛋白质。然后使用酰胺黑测定法对提取的蛋白质进行定量[ 36]。将2×10%的每种样品置于2×lamelli缓冲液(20%甘油,4%SDS,10%2-巯基乙醇,0.004%溴酚蓝和0.125M Tris HCl)中,一式两份进行12%SDS-PAGE。将凝胶在CBB R-250(考马斯亮蓝R-250; Bio Rad)中染色过夜,然后去染色并记录。将每个电泳的样品泳道分成五个部分,并将每个部分进一步加工成更细的1.5mm片。将各级分在40mM碳酸氢铵的50%乙腈(ACN)中洗涤1次,每次用水洗涤1小时,然后用100%ACN脱水。然后用40μl测序级胰蛋白酶(10ng /μl; Promega)消化每个级分18小时。使用在50%ACN中的0.1%三氟乙酸(TFA)提取消化的肽(100μl)。合并每个馏分的各个样品,脱盐,然后真空干燥。然后将肽在20μl的5%ACN和0.1%的甲酸中重构。使用Orbitrap Nano分析仪(Thermo Scientific)对胰蛋白酶消化的肽进行串联质谱(MS / MS)。样品以碰撞诱导的解离模式一式两份运行1小时。从获得的MS / MS峰列表中鉴定出蛋白质Bos taurus数据库。
从每个试验中汇集数据用于分析。结果表示为每组细胞类型的四次试验的平均值±SEM。使用方差分析(ANOVA)进行统计分析。通过用Fisher's最小重要性差异(LSD)测试分析数据来确定平均值之间的显着差异。显着性水平设定为P <0.05。
去:
BuOF和FBS的生化组成如表1所示。除了低密度脂蛋白(LDL)胆固醇和抗坏血酸(其中BuOF较高)外,大多数成分在FBS中高出数倍。
在解冻后立即通过台盼蓝染料排除测定细胞的活力(图1A)。在D10中冷冻的所有三种贴壁细胞系,mES细胞,hPBMC,mBMC和MEF细胞中的细胞解冻后存活率显着低于在D10S20和D10O20中冷冻的新鲜细胞和细胞。在D10O20中冷冻的C18-4细胞,HEK细胞,mES细胞,hPBMC和mBMC的存活率显着低于新鲜细胞,但与在D10S20中冷冻的细胞相似。然而,在D10O20中冷冻的CHO细胞的活力类似于在D10S20中冷冻的新鲜细胞和细胞的活力。在D10O20中冷冻的MEF细胞的活力显着低于在D10S20中冷冻的新鲜细胞和细胞的活力。
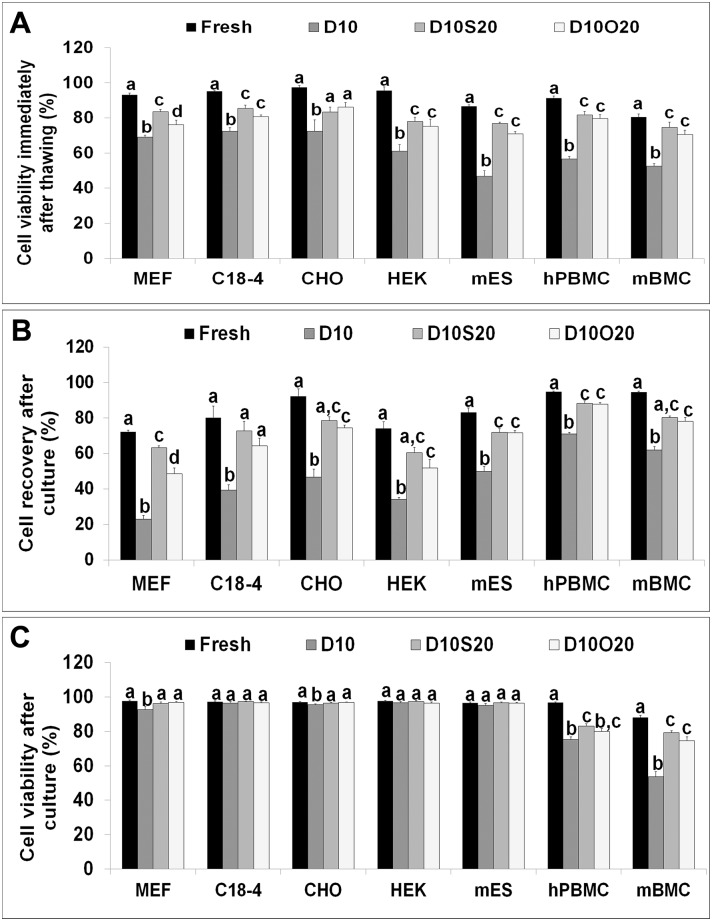
新鲜和冷冻 - 解冻细胞中的细胞活力和细胞恢复。
(A)解冻后立即通过台盼蓝染料排除测定的新鲜和冷冻 - 解冻细胞的细胞活力。(B)24小时(MEF,C18-4,CHO,HEK和mES细胞)和72小时(hPBMC和mBMC)培养物后冷冻 - 解冻细胞的细胞回收百分比。(C)在24小时(MEF,C18-4,CHO,HEK和mES细胞)和72小时(hPBMC和mBMC)培养后通过台盼蓝染料排除测定的细胞活力。数据代表我们对每组中每种细胞类型的试验的平均值±SEM。具有不同字母的条在P <0.05时显着不同。
评估培养后72小时的冻融贴壁细胞24小时和悬浮细胞以确定细胞恢复(图1B)。无论细胞类型如何,D10的细胞恢复均显着下降; 然而,在所有三种贴壁细胞系,mES细胞,hPBMC和mBMC中,D10S20和D10O20的细胞恢复相似。在D10O20中冷冻的C18-4细胞的回收也与新鲜细胞的回收相似。与新鲜细胞相比,D10S20和D10O20中回收的MEF细胞较少,与D10S20相比,在D10O20中回收的细胞较少。
培养后还测定了所有细胞类型的细胞活力(图1C)。C18-4,HEK和mES细胞的活力与包括D10在内的所有冷冻保存组中的新鲜细胞的活力相似。在D10中冷冻的MEF细胞,CHO细胞,hPBMC和mBMC的存活率显着低于在D10S20和D10O20中冷冻的新鲜细胞和细胞的活力。在D10O20中冷冻的hPBMC和mBMC的存活率显着低于新鲜细胞,但与在D10S20中冷冻的细胞相似。
在培养后在冷冻 - 解冻的细胞中分析细胞增殖,早期凋亡,促凋亡和抗凋亡特异性蛋白(分别为PCNA,膜联蛋白V,BAX和BCL2)的表达水平(图2A)。在D10中冷冻保存的所有细胞类型中的PCNA表达低于新鲜细胞中的PCNA表达,并且在D10S20和D10O20中冷冻保存的细胞(图2B))。在D10O20中冷冻的CHO细胞,hPBMC和mES细胞中的PCNA表达类似于在D10S20中冷冻的新鲜细胞和细胞的PCNA表达。在D10O20中冷冻的hPBMC和C18-4细胞中的PCNA表达与在D10S20中冷冻但低于在新鲜细胞中冷冻的那些细胞相似。在MEF细胞中,在D10O20中冷冻的细胞中的PCNA表达低于在D10S20中冷冻保存的新鲜和细胞中的PCNA表达。有趣的是,在D10O20中冷冻的HEK细胞中的PCNA表达与新鲜细胞相似,但高于在D10S20中冷冻的细胞中的PCNA表达。
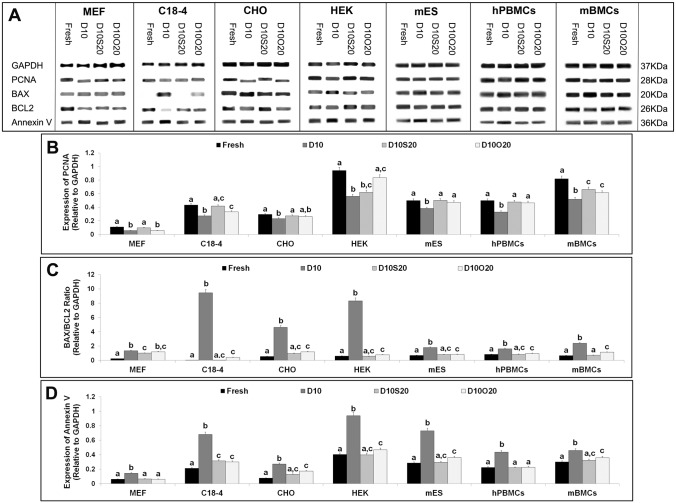
图2
在冻融细胞中表达增殖,促凋亡,抗凋亡和早期凋亡特异性蛋白。
在24小时(MEF,C18-4,CHO,HEK和mES细胞)和72小时(hPBMC和mBMC)培养物后,细胞PCNA,BAX,BCL2和膜联蛋白V分别在新鲜和冷冻 - 解冻的细胞中表达。将每种细胞提取物的30微克等分试样进行SDS-PAGE和蛋白质印迹分析。(A)(B)BAX / BCL2比例,(C)PCNA和(D)膜联蛋白V相对于GAPDH的表达的代表性蛋白质印迹和光密度分析。数据代表我们对每组细胞类型的试验的平均值±SEM。具有不同字母的条在P <0.05时显着不同。
在D10中冷冻的所有细胞类型中BAX / BCL2蛋白的比例显着高于新鲜细胞和在D10S20和D10O20中冷冻保存的细胞(图2C)。尽管与新鲜细胞相比,D10O20中的BAX / BCL2比率更高,但是除了mBMC之外,其在所有细胞类型中与D10S20中冷冻的细胞相似。与在D10S20中冷冻的那些相比,在D10O20中冷冻的mBMC具有更高的BAX / BCL2比率。在D10中冷冻保存的所有七种细胞类型中膜联蛋白V蛋白的表达高于新鲜细胞,并且在D10S20和D10O20中冷冻保存的细胞(图2D))。MEF细胞中的膜联蛋白V表达和在D10O20中冷冻的hPBMC类似于在D10S20中冷冻的新鲜细胞和细胞的表达。在D10O20中冷冻的C18-4细胞,HEK细胞,CHO细胞,mES细胞和mBMC中的膜联蛋白V表达与在D10S20中冷冻但低于新鲜细胞的细胞相似。
通过耗尽丰富蛋白质的样品并对样品进行MS / MS分析来进行BuOF和FBS的蛋白质组学分析。基于Bos taurus数据库中的MS / MS峰搜索,鉴定了BuOF中的41种蛋白质和FBS中的207种蛋白质,其中16种是常见的。在BuOF中鉴定的蛋白质列表及其与FBS的比较显示在表2中。在FBS中鉴定的蛋白质列于S1表中。蛋白质数据库检索和文献检索显示,BuOF含有26%的糖蛋白,9%的球状蛋白,7%的血浆蛋白,9%的脂蛋白和7%的细胞骨架蛋白。在16种常见蛋白中,白蛋白是FBS和BuOF中鉴定的主要蛋白质。
BuOF蛋白质组学分析及与FBS的比较。
蛋白质的名称 | 分子量(kDa) | 蛋白质类型/作用 | 无论是在FBS还是在场 | |
1 | 载脂蛋白AI前体 | 30.3 | 高密度脂蛋白/促进细胞增殖和抑制细胞凋亡[ 77 ] | 当下 |
2 | 纤连蛋白可变区 | 20.4 | 糖蛋白/诱导细胞增殖,抑制细胞凋亡[ 83],并有助于提高冷冻保存精子的生育率[84 ] | 当下 |
3 | 运甲状腺素蛋白前体 | 15.7 | 甲状腺素结合前白蛋白 | 当下 |
4 | 血清白蛋白 | 53.9 | 球状蛋白/替代血清有效冷冻保存PBMC细胞[ 27 ] | 当下 |
五 | α-1-B糖蛋白前体 | 53.5 | 糖蛋白 | 当下 |
6 | 凝 | 80.7 | 溶血磷脂酸转运蛋白/抗氧化特性[ 73 ]并参与细胞凋亡的控制和执行[ 72 ] | 当下 |
7 | 补充部分3 | 187.1 | 糖蛋白 | 当下 |
8 | 角蛋白5,II型 | 62.6 | 细胞骨架蛋白 | 当下 |
9 | 间α-胰蛋白酶抑制剂重链H2前体 | 106.1 | 载体蛋白 | 当下 |
10 | 白蛋白 | 69.2 | 球状蛋白/替代sserum有效冷冻保存PBMC细胞[ 27 ] | 当下 |
11 | 补体因子B前体 | 85.3 | 循环蛋白 | 当下 |
12 | 角蛋白7,II型 | 50 | 细胞骨架蛋白 | 当下 |
13 | 转铁蛋白同种型X1 | 77.6 | 糖蛋白/主要抗氧化蛋白和保护精子免受冻融过程中的氧化损伤[ 69 ] | 当下 |
14 | 角蛋白42,类型1喜欢异构体X3 | 50.3 | 细胞骨架蛋白 | 当下 |
15 | Serpin肽酶抑制剂,进化枝A(α-1抗蛋白酶,抗胰蛋白酶),成员1异构体X1 | 46.1 | 通过抑制caspase-3来抑制酶/抑制细胞凋亡[ 75 ] | 当下 |
16 | BSA链的晶体结构b | 66.4 | 球状蛋白/替代血清有效冷冻保存PBMC细胞[ 27 ] | 当下 |
17 | α-2-HS-糖蛋白前体 | 38.4 | 糖蛋白 | 缺席 |
18 | Serpin肽酶抑制剂,进化枝A(α-1抗蛋白酶,抗胰蛋白酶),成员3 | 22.7 | 球蛋白糖蛋白/通过抑制caspase-3抑制细胞凋亡[ 75 ] | 缺席 |
19 | Regucalcin | 33.3 | 钙结合蛋白/维持细胞稳态和在许多细胞类型的细胞信号系统中作为抑制蛋白的作用[ 81 ] | 缺席 |
20 | 牛因子Vai的晶体结构,链A. | 34.7 | 因子Va的灭活形式 | 缺席 |
21 | 内啡肽2C | 46.7 | 因此,serpin /抑制半胱氨酸蛋白酶和弹性蛋白酶样丝氨酸蛋白酶的类型最终会抑制细胞凋亡[ 85 ] | 缺席 |
22 | 胎球蛋白B前体 | 42.6 | 糖蛋白/抗氧化剂,通过增加ROS清除酶帮助维持精子形态[ 82 ] | 缺席 |
23 | 纤维蛋白原α链 | 18.1 | 糖蛋白 | 缺席 |
24 | 载脂蛋白E | 27.1 | 脂蛋白 | 缺席 |
25 | C型凝集素结构域家族3,成员B前体 | 22.1 | 纤溶酶原结合蛋白 | 缺席 |
26 | 脂联素 | 26.1 | 激素(细胞因子) | 缺席 |
27 | 转铁蛋白前体 | 77.7 | 糖蛋白/主要抗氧化蛋白和保护精子免受冻融应激过程中的氧化损伤[ 69 ] | 缺席 |
28 | 间α-胰蛋白酶抑制剂重链1前体 | 101.2 | 丝氨酸蛋白酶抑制剂 | 缺席 |
29 | 角蛋白25,我喜欢 | 49.3 | 中间丝 | 缺席 |
三十 | 牛血红蛋白链C. | 15 | 金属蛋白酶 | 缺席 |
31 | 血红蛋白,β | 16 | 珠蛋白 | 缺席 |
32 | 载脂蛋白N. | 28.5 | 脂蛋白 | 缺席 |
34 | 胶原蛋白,III型,α1 | 137.1 | 纤维硬蛋白 | 缺席 |
35 | 免疫球蛋白轻链 | 10.4 | 多肽 | 缺席 |
36 | α-2-巨球蛋白变体1 | 115.1 | 血浆蛋白/蛋白酶抑制剂和抗凋亡蛋白[ 86] | 缺席 |
37 | α-2-巨球蛋白变体4 | 42.3 | 血浆蛋白/蛋白酶抑制剂和抗凋亡蛋白[ 86] | 缺席 |
38 | Kininogen异构体X2 | 44.4 | 多肽 | 缺席 |
39 | 蛋白质变暗了 | 39.4 | 螺旋 - 环 - 螺旋蛋白 | 缺席 |
40 | 伯胺氧化酶 | 81.7 | 含铜酶/细胞生长和分化的生物调节剂,也通过改变膜参与细胞凋亡调控[ 78 ] | 缺席 |
41 | 肌动蛋白,α2,平滑肌,主动脉 | 39.3 | 球状蛋白质 | 缺席 |
42 | 亚甲基四氢叶酸脱氢酶(NADP +依赖)1样 | 81.6 | 连接酶 | 缺席 |
因为FBS富含几种生长因子和蛋白质,所以它通常用作细胞和组织培养物的培养基补充剂。FBS还用作非渗透性冷冻保护剂,用于冷冻保存几种细胞类型。高成本,道德问题以及传播血液传播疾病的可能性导致需要找到冷冻保存的替代品[ 22 ]。迄今为止,许多血清替代已被引入用于细胞冻存[ 25 - 27 ]; 然而,它们的使用是有限的,主要是因为它们的高成本和采购困难。在本研究中,我们研究了BuOF是否可以替代FBS用于几种不同细胞类型的冷冻保存。
发现BuOF的生化组成与FBS的生化组成不同。发现除LDL胆固醇和抗坏血酸外的所有成分在FBS中以更高的浓度存在(分别在BuOF中高约1.8倍和6.4倍; 表1)。LDL胆固醇含有85-90%的脂类以及10-15%的蛋白质[ 37 ],并负责在冻融[凝胶化过程37 - 40 ]。通过提供流体稳定性,BuOF中存在更高的LDL胆固醇含量可有利于细胞冷冻保存。LDL胆固醇通过阻止精子细胞膜中磷脂和胆固醇的外流来保护精子细胞免受冷休克[ 41]]。蛋黄,其中富含LDL胆固醇,已被证明是公牛精子的有效冷冻保存液[ 42,43 ],种马[ 44 ],公羊[ 45 ],和狗[ 46 ]。
抗坏血酸是一种微量营养素,可以防止细胞凋亡过程中发生的膜去极化和细胞色素C释放事件[ 47]。Lane 等人。观察到用抗坏血酸冷冻保存的小鼠胚胎中乳酸脱氢酶水平显着降低[ 48 ]。在BuOF中存在高浓度的抗坏血酸可以起到防止自由基损害的作用,这是在细胞冷冻期间或之后立即丧失生存能力的原因之一[ 49]]。因此,在该研究中维持了不同细胞系的活力。此外,BuOF中高浓度的抗坏血酸可能是细胞系中膜联蛋白V表达和BAX / BCL2比例与在BuOF和FBS中冷冻保存的hPBMC的相似性的原因。然而,目前尚不清楚该效果是否完全是由于抗坏血酸或BuOF中的一些其他成分。
膜联蛋白V表达已被用于评估早期凋亡细胞[ 50 ],而BAX(促凋亡)与BCL2(抗凋亡)基因表达的比率表明冷冻保存细胞对细胞凋亡的易感性[ 51 ]。之前的研究表明,膜联蛋白V检测可用于检测冻融人类精子的膜完整性[ 52 ]。此外,BAX / BCL2比率用于确定体外培养不同阶段的胚胎和卵母细胞的质量[ 53]]。在D10S20或D10O20除了mBMC和在D10中冷冻的细胞中冷冻保存的所有细胞类型中,相对膜联蛋白V表达和BAX / BCL2比例相似。这些发现表明,在本研究中冷冻保存的大多数细胞类型中,FBS和BuOF都具有相似的抑制细胞凋亡的能力。尽管在D10O20中冷冻的小鼠初级悬浮细胞如mBMC中,BAX / BCL2比例与在D10中冷冻的细胞相似。然而,在任一组中冷冻保存的mBMC中膜联蛋白V的表达没有差异。这些发现表明,与BuOF不同,FBS有利于预防mBMCs的晚期凋亡。有趣的是,两种组中人原代细胞(hPBMCs)中膜联蛋白V的表达和BAX / BCL2比例相似。这些结果表明,与hPBMC不同,mBMC在冷冻保存期间对细胞凋亡非常敏感。54,55 ]。这可能解释了小鼠原代细胞中BAX / BCL2比值的升高。
从低温储存中回收活细胞是一个主要问题[ 56 ]。最初,所有的细胞类型的活力解冻比较BuOF和FBS冷冻能力后,立即进行了估计,在早期的研究报道[ 26,27,57]。尽管在解冻后立即在D10O20中冷冻的MEF细胞的存活率低,但培养细胞中膜联蛋白V和BAX / BCL2比率的表达与在D10S20中冷冻的细胞没有差异。这些发现表明虽然BuOF不能保持最初的生存能力,但它可以防止冻融MEF细胞的早期和晚期凋亡。相反,在D10中冷冻的所有细胞类型不仅在解冻后立即具有较低的细胞活力,而且在培养的细胞中具有升高的膜联蛋白V和BAX / BCL2比率。这些发现表明,在cryomedia中存在FBS或BuOF显着增强细胞存活并防止细胞凋亡。有趣的是,在D10中冷冻的少数培养的贴壁细胞如C18-4,HEK和mES细胞的细胞存活率与其他组中冷冻的细胞没有差异,但这些细胞中膜联蛋白V和BAX / BCL2的比例明显较高。这些结果表明仅仅恢复冷冻融化细胞的细胞活力不能成为冷冻保存培养基提供的冷冻保护的可靠指标[58 ]。评估冷冻融化细胞中凋亡特异性蛋白的表达也是必不可少的[ 59 ]。由于不同细胞以不同的速率生长,培养后的细胞恢复是评估低温保存后其生长速度的理想方法。细胞的恢复可以通过细胞回收百分比[ 60 ]和增殖细胞特异性蛋白质如PCNA的表达来评估[ 61 ]。冷冻解冻的鼠神经前体细胞保留了它们的增殖能力,如PCNA表达所示[ 62]。在本研究中使用的所有细胞类型中,在单独DMSO中冷冻的细胞中回收的细胞百分比和PCNA表达(D10)显着低于用DMSO和FBS或BuOF冷冻的细胞。这些发现进一步支持在低温介质中使用FBS或BuOF进行细胞冷冻保存。
然而,对于在D10O20中冷冻保存的MEF细胞,细胞恢复和PCNA表达显着低于在D10S20中冷冻保存的细胞中的细胞,并且24小时后恢复的培养细胞的存活率与新鲜细胞和在D10S20中冷冻的细胞没有差异。这种差异可能是因为MEF细胞是原代细胞,并且在冷冻保存后需要超过24小时才能恢复细胞生长和增殖。另一个合理的解释可能是FBS中存在更高的蛋白质,脂蛋白和甘油三酯含量导致更好的冷冻保存MEF细胞。缓激肽[ 63 ],微管蛋白[ 64 ],热休克蛋白90 [ 65 ]和超氧化物歧化酶[ 66]据报道,它们在公牛精子冷冻保存中发挥作用。Enolase是一种金属酶,可通过减少氧化应激和细胞毒性来代替DMSO,从而在大鼠肝细胞的冷冻保存中取代[ 67 ]。这些蛋白质仅在FBS中的存在可能提供优异的冷冻保护作用。
尽管BuOF的蛋白质含量远低于FBS的蛋白质含量,但是进行了BuOF和FBS的比较蛋白质组学分析以鉴定可能对冷冻保存至关重要的蛋白质/肽。通过MS / MS分析在BuOF中鉴定出总共41种蛋白质。大多数蛋白质是糖蛋白,球状蛋白质和脂蛋白。在41种鉴定的蛋白质中,16种也存在于FBS中(表2)。先前在人类玻璃体液中报道了存在于FBS和BuOF中的转运蛋白,如白蛋白,血清转铁蛋白,转甲状腺素蛋白和载脂蛋白AI [ 68 ],这证实了本研究中遵循的蛋白质组学方法。
这些蛋白质在生物学上是必需的,在细胞稳态中具有重要作用,并且充当激素载体。转铁蛋白在冻融胁迫期间保护精子免受氧化损伤[ 69 ]。纤维连接蛋白是另一种在BuOF中发现的重要糖蛋白,在细胞 - 细胞聚集,细胞 - 基质粘附,细胞与细胞外基质成分的附着和细胞运动中起重要作用[ 70 ]。凝溶胶蛋白是一种肌动蛋白丝,可以封闭和切断提高细胞迁移速率的蛋白[ 71 ],参与细胞凋亡的控制和执行[ 72 ]。这种溶血磷脂酸转运蛋白被认为具有抗氧化特性[ 73]。这些蛋白质在BuOF中的存在可能是冷冻保存细胞系中促凋亡蛋白质表达降低的原因。
几种蛋白水解酶与细胞凋亡和相关过程有关。BuOF中的α-1抗蛋白酶(A1P1)是丝氨酸蛋白酶抑制剂(serpin)[ 74 ],通过抑制caspase-3活性来调节细胞凋亡[ 75 ]。发现在BuOF和FBS中鉴定的许多蛋白质参与脂质转运和结合以及细胞迁移。Transthyretin是一种BuOF中的转运蛋白,参与脂质代谢[ 76 ]。据报道载脂蛋白AI是高密度脂蛋白(HDL)的主要成分,可促进内皮细胞和血管平滑肌细胞的增殖并抑制细胞凋亡[ 77]]。这些蛋白质在BuOF中的存在对于防止冷冻和解冻期间的细胞凋亡可能是至关重要的。
一些蛋白质仅在BuOF中被鉴定出来。胺氧化酶和激肽原报告在预防细胞凋亡[中发挥至关重要的作用78,79 ]。肌动蛋白在细胞结构,运动和细胞分裂中起着至关重要的作用[ 77 ]。肌动蛋白的损伤会在冷冻保护剂如丙二醇和DMSO的存在下改变微管组织[ 80 ]。BuOF中存在的球状和糖蛋白有助于重要的细胞功能,例如细胞分裂过程中细胞的迁移和收缩。Regucalcin在许多细胞类型的细胞信号系统中具有抑制蛋白的作用[ 81]。胎球蛋白(Fetuin)是一种糖蛋白和蛋白酶抑制剂,可增加超氧化物歧化酶和谷胱甘肽过氧化物酶的酶活性,从而最大限度地减少冷冻精液中的膜和DNA损伤[ 82 ]。这些蛋白质是否在细胞冷冻保存中起关键作用需要进一步研究。
这是一项初步研究,确定BuOF是冷冻保存培养基中FBS的替代品。眼液的组成可随着年龄,性别,品种,起源以及动物的生理和健康状况而变化。眼液组成的变化可能影响冷冻保存细胞的细胞存活和基因表达。因此,在BuOF可以用于商业应用之前,需要进一步的研究和标准化。
总之,本研究证明了粘附细胞系(如CHO,HEK,C18-4和mES细胞)和初级悬浮细胞(如20%BuOF中的hPBMC和mBMC)的有效低温保存,以及其在低温介质中替代FBS的潜力。由于小鼠原代细胞(mBMC和MEF细胞)易受冷冻损伤影响,因此需要进一步研究使用BuOF进行冷冻保存。BuOF的蛋白质组学和生物化学分析鉴定了可能在细胞冷冻保存中起关键作用的几种组分。进一步的研究阐明了BuOF在几种不同细胞类型中的作用,可以帮助建立BuOF作为无血清冷冻保存方案的重要组成部分。
去:
胎牛血清(FBS)的蛋白质组学分析。
(DOCX)
单击此处获取其他数据文件。(68K,docx)
去:
我们要感谢Prabhu先生协助收集屠宰场的水牛眼。
去:
这项工作得到了印度政府科学与工业研究理事会(CSIR)(授权号BSC0207)和中央动物园管理局(CZA),GOI(授权号GAP0389)的支持。资助者在研究设计,数据收集和分析,决定发表或准备手稿方面没有任何作用。
去:
所有相关数据均在论文及其支持信息文件中。
去:
1. Stephenne X,Najimi M,Sokal EM。肝细胞冷冻保存:是时候改变策略吗? 世界胃肠病学杂志:WJG。2010; 16(1):1-14。 [ PMC免费文章 ] [ PubMed ] [ Google学术搜索 ]
2. Grove JE,Bruscia E,Krause DS。骨髓来源干细胞的可塑性。干细胞。2004; 22(4):487-500。10.1634 / stemcells.22-4-487。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
3. Sethe S,Scutt A,Stolzing A. 间充质干细胞的衰老。老龄化研究评论。2006; 5(1):91-116。10.1016 / j.arr.2005.10.001。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
4. Stolzing A,Scutt A. 年龄相关的间充质祖细胞功能受损。老化细胞。2006; 5(3):213-24。10.1111 / j.1474-9726.2006.00213.x。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
5. Evans MJ,Kaufman MH。从小鼠胚胎培养多能细胞。自然。1981; 292(5819):154-6。。[ PubMed ] [ Google学术搜索 ]
6. Lakshmipathy U,Pelacho B,Sudo K,Linehan JL,Coucouvanis E,Kaufman DS,et al。 有效转染胚胎和成体干细胞。干细胞。2004; 22(4):531-43。10.1634 / stemcells.22-4-531。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
7. de Rooij DG,Russell LD。所有你想知道的精原细胞,但不敢问。男科学杂志。2000; 21(6):776-98。。[ PubMed ] [ Google学术搜索 ]
8. 汗KH。哺乳动物细胞中的基因表达及其应用。先进的药物通报。2013; 3(2):257-63。10.5681 / apb.2013.042 [ PMC免费文章 ] [ PubMed ] [ CrossRef ] [ Google学术搜索 ]
9. Yu J,Vodyanik MA,Smuga-Otto K,Antosiewicz-Bourget J,Frane JL,Tian S,et al。 诱导的多能干细胞系来源于人体细胞。科学。2007; 318(5858):1917-20。10.1126 / science.1151526。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
10. Thomson JA,Itskovitz-Eldor J,Shapiro SS,Waknitz MA,Swiergiel JJ,Marshall VS,et al。 源自人胚泡的胚胎干细胞系。科学。1998; 282(5391):1145-7。。[ PubMed ] [ Google学术搜索 ]
11. Sambor A,Garcia A,Berrong M,Pickeral J,Brown S,Rountree W,et al。 建立和维护用于支持临床疫苗试验的功能性细胞研究的PBMC储存库。免疫学方法杂志。2014; 409:107-16。10.1016 / j.jim.2014.04.005 [ PMC免费文章 ] [ PubMed ] [ CrossRef ] [ Google学术搜索 ]
12. Makedonas G,Betts MR。住在一个纸牌屋:重新评估CD8 + T细胞免疫与HIV的关联。免疫学评论。2011; 239(1):109-24。10.1111 / j.1600-065X.2010.00968.x [ PMC免费文章 ] [ PubMed ] [ CrossRef ] [ Google学术搜索 ]
13. Spencer HT,Sleep SE,Rehg JE,Blakley RL,Sorrentino BP。用于使骨髓细胞对三甲氧喋呤具有抗性的基因转移策略。血。1996; 87(6):2579-87。。[ PubMed ] [ Google学术搜索 ]
14. Asahara T,Masuda H,Takahashi T,Kalka C,Pastore C,Silver M,et al。 内皮祖细胞的骨髓来源负责生理和病理性新血管形成中的出生后血管发生。流通研究。1999; 85(3):221-8。。[ PubMed ] [ Google学术搜索 ]
15. Yair Reisner L,Asher Meshorer,Nathan Sharon。利用凝集素分离的小鼠骨髓和脾细胞进行造血干细胞移植。Proc Nati Acad Sci USA。1978; 75(6):2933-6。[ PMC免费文章 ] [ PubMed ] [ Google学术搜索 ]
16. 奥尔利克d,KajsturaĴ,奇门S,博丁DM,LERI A,Anversa酒店P. 骨髓干细胞再生梗塞心肌。小儿移植。2003; 7 Suppl 3:86-8。。[ PubMed ] [ Google学术搜索 ]
17. 施马勒K,拉德马赫T,费歇尔R,海尔威格S. 走向转基因BY-2细胞培养物的工业有用性-冷冻细胞银行。生物技术杂志。2006; 124(1):302-11。10.1016 / j.jbiotec.2006.01.012。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
18. 富勒BJ。冷冻保护剂:在冰冻状态下保护生命的基本防冻剂。冷冻字母。2004; 25(6):375-88。。[ PubMed ] [ Google学术搜索 ]
19. Mellor DJ,Gregory NG。胎儿和新生羊羔的反应,行为唤醒和意识:实验,实践和治疗意义。新西兰兽医杂志。2003; 51(1):2-13。10.1080 / 00480169.2003.36323。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
20. Jochems CE,van der Valk JB,Stafleu FR,Baumans V. 胎牛血清的使用:伦理或科学问题? 实验动物的替代品:ATLA。2002; 30(2):219-27。Epub 2002/04/25。。[ PubMed ] [ Google学术搜索 ]
21. Erickson GA,Bolin SR,Landgraf JG。用于组织培养的胎牛血清的病毒污染:风险和担忧。生物标准化的发展。1991; 75:173-5。。[ PubMed ] [ Google学术搜索 ]
22. Tekkatte C,Gunasingh GP,Cherian KM,Sankaranarayanan K. “人源化”干细胞培养技术:动物血清争议。干细胞国际。2011; 2011:504723 10.4061 / 2011/504723 [ PMC免费文章 ] [ PubMed ] [ CrossRef ] [ Google学术搜索 ]
23. Bielanski A,Bergeron H,Lau PC,Devenish J. 长期在液氮中储存的胚胎和精液的微生物污染。低温生物学。2003; 46(2):146-52。。[ PubMed ] [ Google学术搜索 ]
24. Hubalek Z. 保护剂用于冷冻保存微生物。低温生物学。2003; 46(3):205-29。。[ PubMed ] [ Google学术搜索 ]
25. Tsujimoto K,Takagi H,Takahashi M,Yamada H,Nakamori S. 富含丝氨酸的重复序列在丝蛋白丝胶中的低温保护作用。生物化学杂志。2001; 129(6):979-86。。[ PubMed ] [ Google学术搜索 ]
26. Sasaki M,Kato Y,Yamada H,Terada S. 使用丝蛋白丝胶蛋白开发用于哺乳动物细胞的新型无血清冷冻培养基。生物技术和应用生物化学。2005; 42(Pt 2):183-8。10.1042 / BA20050019 [ PubMed ] [ CrossRef ] [ Google学术搜索 ]
27. Germann A,Schulz JC,Kemp-Kamke B,Zimmermann H,von Briesen H. 标准化无血清Cryomedia维持外周血单核细胞活力,恢复和抗原特异性T细胞反应与胎牛血清基于培养基的比较。生物保存和生物银行。2011; 9(3):229-36。10.1089 / bio.2010.0033 [ PMC免费文章 ] [ PubMed ] [ CrossRef ] [ Google学术搜索 ]
28. Filipic B,Shehata M,Toth S,Schwarzmeier J,Koren S. 基于牛眼液的新型血清替代品:一种在体外培养不同动物细胞的有用工具。Altex。2002; 19(1):15-20。。[ PubMed ] [ Google学术搜索 ]
29. Miller JW,Adamis AP,Shima DT,D'Amore PA,Moulton RS,O'Reilly MS,et al。 血管内皮生长因子/血管通透因子在灵长类动物模型中与眼部血管生成在时间上和空间上相关。美国病理学杂志。1994; 145(3):574-84。Epub 1994/09/01。 [ PMC免费文章 ] [ PubMed ] [ Google学术搜索 ]
30. Camina JP,Casabiell XA,Perez FR,Lage M,Casanueva FF。从牛玻璃体中分离生物活性Ca(2+) - 动员复合脂质。生化和生物物理研究通讯。1998; 244(3):696-700。Epub 1998/04/16。10.1006 / bbrc.1998.8320。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
31. Webster L,Stanbury RM,Chignell AH,Limb GA。葡萄膜炎玻璃体细胞间粘附分子1合并视网膜脱离。英国眼科杂志。1998; 82(4):438-43。Epub 1998/06/26。 [ PMC免费文章 ] [ PubMed ] [ Google学术搜索 ]
32. Grus FH,Joachim SC,Pfeiffer N. 眼液中的蛋白质组学。蛋白质组学临床应用。2007; 1(8):876-88。10.1002 / prca.200700105。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
33. 霍夫曼MC,Braydich-斯托勒L,Dettin L,约翰逊E,迪姆M. 小鼠种系干细胞永生化。干细胞。2005; 23(2):200-10。10.1634 / stemcells.2003-0036 [ PMC免费文章 ] [ PubMed ] [ CrossRef ] [ Google学术搜索 ]
34. Samuelson LC,Metzger JM。原代小鼠胚胎成纤维细胞(MEF)的分离和冷冻用于饲养板。CSH协议。2006; 2006(2)。10.1101 / pdb.prot4482。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
35. Krause DS,Theise ND,Collector MI,Henegariu O,Hwang S,Gardner R,et al。 由单个骨髓来源的干细胞进行的多器官,多谱系植入。细胞。2001; 105(3):369-77。Epub 2001/05/12。。[ PubMed ] [ Google学术搜索 ]
36. 夏弗纳W,韦斯曼C. 用于蛋白的稀溶液测定快速,灵敏,和特异性的方法。分析生物化学。1973; 56(2):502-14。Epub 1973/12/01。。[ PubMed ] [ Google学术搜索 ]
37. Hu JH,Li QW,Li G,Chen XY,Yang H,Zhang SS,et al。 对蛋黄低密度脂蛋白冷冻解冻公猪精液的冷冻保护作用。Asian-Aust J Anim Sci 2006;(19):486-90。[ Google学术搜索 ]
38. Lamia Tainturiera,Lae TJ,Chantal,Olivier G.,Jean LC,et al。 使用蛋黄LDL冷冻保存后的公牛精液体外生育能力:与商业蛋黄增量剂Optidyl1进行比较。Theriogenology 2004; 61 895-907。[ PubMed ] [ Google学术搜索 ]
39. BOE-汉森GB,莫里斯ID,Ersboll AK,格雷夫T,Christensen的P. 在通过中性彗星试验和精子染色质结构分析评价性控公牛精子DNA完整性。Theriogenology。2005; 63(6):1789-802。Epub 2005/03/15。10.1016 / j.theriogenology.2004.08.004。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
40. Moussa M,Marinet V,Trimeche A,Tainturier D,Anton M. 通过简单的方法从母鸡蛋黄中提取的低密度脂蛋白:对冻融公牛精液的冷冻保护作用。Theriogenology。2002; 57(6):1695-706。Epub 2002/05/31。。[ PubMed ] [ Google学术搜索 ]
41. Amirat L,Tainturier D,Jeanneau L,Thorin C,Gerard O,Courtens JL,et al。 使用蛋黄低密度脂蛋白低温保存后的公牛精液体外生育能力:与商业蛋黄增量剂Optidyl进行比较。Theriogenology。2004; 61(5):895-907。。[ PubMed ] [ Google学术搜索 ]
42. Hu JH,Li QW,Jiang ZL,Li WY。不同增量剂对冻融后公猪精子DNA完整性的影响。低温生物学。2008; 57(3):257-62。Epub 2008/10/07。10.1016 / j.cryobiol.2008.09.004。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
43. Vera-Munoz O,Amirat-Briand L,Diaz T,Vasquez L,Schmidt E,Desherces S,et al。 使用低密度脂蛋白(LDL)增量剂对每个剂量的低精子数量的精液稀释对低温保存的牛精子的运动性和功能性的影响:与Triladyl和Bioxcell的比较。Theriogenology。2009年; 71(6):895-900。Epub 2009/01/02。10.1016 / j.theriogenology.2008.10.010。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
44. Pillet E,Duchamp G,Batellier F,Beaumal V,Anton M,Desherces S,et al。 蛋黄等离子体可以替代种马冷冻扩展器中的蛋黄。Theriogenology。2011; 75(1):105-14。Epub 2010/09/14。10.1016 / j.theriogenology.2010.07.015。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
45. Moustacas VS, Zaffalon FG, Lagares MA, Loaiza-Eccheverri AM, Varago FC, Neves MM, et al.Natural, but not lyophilized, low density lypoproteins were an acceptable alternative to egg yolk for cryopreservation of ram semen. Theriogenology. 2011;75(2):300–7. Epub 2010/10/12. 10.1016/j.theriogenology.2010.08.016 . [PubMed] [CrossRef] [Google Scholar]
46. Varela Junior AS,Corcini CD,Ulguim RR,Alvarenga MV,Bianchi I,Correa MN,et al。 低密度脂蛋白对冷冻保存犬精液质量的影响。动物繁殖科学。2009年; 115(1-4):323-7。Epub 2008/12/23。10.1016 / j.anireprosci.2008.11.002。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
47. Kc S,Carcamo JM,Golde DW 。维生素C通过促进葡萄糖转运蛋白1(Glut1)进入线粒体,并赋予线粒体保护免受氧化损伤。FASEB期刊:美国实验生物学学会联合会的官方出版物。2005; 19(12):1657-67。10.1096 / fj.05-4107com。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
48. Lane M,Maybach JM,Gardner DK。在冷冻保存期间添加抗坏血酸会刺激随后的胚胎发育。人类繁殖。2002; 17(10):2686-93。。[ PubMed ] [ Google学术搜索 ]
49. Tariq SA。抗坏血酸在清除自由基中的作用和生物系统中的铅毒性。分子生物技术。2007; 37(1):62-5。。[ PubMed ] [ Google学术搜索 ]
50. Zhang G,Gurtu V,Kain SR,Yan G. 使用膜联蛋白V的荧光缀合物早期检测细胞凋亡。生物技术。1997; 23(3):525-31。Epub 1997/09/23。。[ PubMed ] [ Google学术搜索 ]
51. Rao BS,Mahesh YU,Charan KV,Suman K,Sekhar N,Shivaji S. 玻璃化对未成熟山羊卵丘卵母细胞复合体中减数分裂成熟和基因表达的影响。低温生物学。2012; 64(3):176-84。Epub 2012/01/28。10.1016 / j.cryobiol.2012.01.005。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
52. Glander HJ,沙勒J. 膜联蛋白V的结合人精子的质膜:用于检测cryostorage后膜的变化的快速检测。分子人类繁殖。1999; 5(2):109-15。。[ PubMed ] [ Google学术搜索 ]
53. Yang MY,Rajamahendran R. Bcl-2和Bax蛋白在体外产生的牛卵母细胞和胚胎质量方面的表达。动物繁殖科学。2002; 70(3-4):159-69。。[ PubMed ] [ Google学术搜索 ]
54. Gottifredi V SSY,Prives C. 在不同形式的应激和不同细胞周期阶段对p53的调节。Cold Spring Harbor Symp Quant Biol。2000; 65:483-8。[ PubMed ] [ Google学术搜索 ]
55. Schultz LB NHC,Malikzay A,DiTullio RA Jr.,Stavridi ES,Halazonetis TD DNA损伤检查点和人类癌症。Cold Spring Harbor Symp Quant Biol。2000; 65:489-98。[ PubMed ] [ Google学术搜索 ]
56. Osterling M,Earley E. 一种可靠的方法,用于回收冷冻保存的杂交瘤细胞进行克隆。组织培养方法杂志。1985; 9(3):171-3。10.1007 / BF01665926 [ CrossRef ] [ Google学术搜索 ]
57. 穆勒P,奥里希H,Wenkel R,Schaffner产品I,沃尔夫I,瓦尔多夫J,等。 猪肝细胞的无血清冷冻保存。细胞和组织研究。2004; 317(1):45-56。Epub 2004/06/09。10.1007 / s00441-004-0894-6。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
58. 小M,Dooley DC。储存后人脐带血细胞活力和细胞凋亡的评估。血液疗法与干细胞研究杂志。2003; 12(1):115-22。Epub 2003/03/29。10.1089 / 152581603321210190。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
59. Heng BC,Ye CP,Liu H,Toh WS,Rufaihah AJ,Yang Z,et al。 使用常规缓慢冷却方案冻融完整和粘附的人胚胎干细胞期间的活力丧失主要是由于细胞凋亡而不是细胞坏死。生物医学科学杂志。2006; 13(3):433-45。Epub 2005/12/24。10.1007 / s11373-005-9051-9。[ PubMed ] [ CrossRef] [ Google学术搜索 ]
60. Zhao J,Hao HN,Thomas RL,Lyman WD。一种有效的冷冻保存胎儿人肝脏造血祖细胞的方法。干细胞。2001; 19(3):212-8。10.1634 / stemcells.19-3-212。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
61. Kubben FJ,Peeters-Haesevoets A,Engels LG,Baeten CG,Schutte B,Arends JW,et al。 增殖细胞核抗原(PCNA):研究人结肠细胞增殖的新标记。肠道。1994; 35(4):530-5。[ PMC免费文章 ] [ PubMed ] [ Google学术搜索 ]
62. Milosevic J,Storch A,Schwarz J. 冷冻保存不影响小鼠神经前体细胞的增殖和多能性。干细胞。2005; 23(5):681-8。10.1634 / stemcells.2004-0135。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
63. Shukla MK,Misra AK。缓激肽对Murrah buffalo(Bubalus bubalis)精液冷冻保存的影响。动物繁殖科学。2007; 97(1-2):175-9。Epub 2006/04/08。10.1016 / j.anireprosci.2006.02.015。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
64. Eyer J,White D,Gagnon C. 在牛精子动力蛋白制剂中存在新的微管冷稳定因子。生化期刊。1990; 270(3):821-4。 [ PMC免费文章 ] [ PubMed ] [ Google学术搜索 ]
65. Fukuda A,Osawa T,Oda H,Tanaka T,Toyokuni S,Uchida K. 铁诱导的急性肾毒性中的氧化应激反应:热休克蛋白的表达增强90。生化和生物物理研究通讯。1996; 219(1):76-81。10.1006 / bbrc.1996.0184。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
66. Wang P,Wang YF,Wang H,Wang CW,Zan LS,Hu JH,et al。 HSP90的表达与公牛精子的抗冻性有关。Zygote。2014; 22(2):239-45。10.1017 / S096719941300004X。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
67. Averill-Bates DA,YéeMC-S,Grondin M,Sarhan F,Ouellet F. C-1003:用小麦蛋白冷冻保存大鼠肝细胞:在氧化应激保护中的作用。低温生物学。2014; 69(3):512-3。10.1016 / j.cryobiol.2014.09.332 [ CrossRef ] [ Google学术搜索 ]
68. Koss MJ,Hoffmann J,Nguyen N,Pfister M,Mischak H,Mullen W,et al。 渗出性年龄相关性黄斑变性患者玻璃体液蛋白质组学研究。PloS一个。2014; 9(5):e96895 Epub 2014/05/16。10.1371 / journal.pone.0096895 [ PMC免费文章 ] [ PubMed ] [ CrossRef ] [ Google学术搜索 ]
69. Li P,Hulak M,Koubek P,Sulc M,Dzyuba B,Boryshpolets S,et al。 冰期耐力:冷冻保存对鲤鱼(Cyprinus carpio L.)精子蛋白质的影响。Theriogenology。2010; 74(3):413-23。10.1016 / j.theriogenology.2010.02.024。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
70. Reid T,Kenney C,Waring GO。牛房水中纤维连接蛋白的分离与鉴定。调查眼科学和视觉科学。1982; 22(1):57-61。Epub 1982/01/01。。[ PubMed ] [ Google学术搜索 ]
71. Cunningham CC,Stossel TP,Kwiatkowski DJ。增强过度表达凝溶胶蛋白的NIH 3T3成纤维细胞的运动性。科学。1991; 251(4998):1233-6。Epub 1991/03/08。。[ PubMed ] [ Google学术搜索 ]
72. Burtnick LD,Urosev D,Irobi E,Narayan K,Robinson RC。与肌动蛋白结合的凝溶胶蛋白的N-末端一半的结构:在切断,凋亡和FAF中的作用。EMBO期刊。2004; 23(14):2713-22。10.1038 / sj.emboj.7600280 [ PMC免费文章 ] [ PubMed ] [ CrossRef ] [ Google学术搜索 ]
73. Pages C,Simon MF,Valet P,Saulnier-Blache JS。溶血磷脂酸的合成和释放。前列腺素和其他脂质介质。2001; 64(1-4):1-10。。[ PubMed ] [ Google学术搜索 ]
74. Gettins PG。Serpin结构,机制和功能。化学评论。2002; 102(12):4751-804。。[ PubMed ] [ Google学术搜索 ]
75. Petrache I,Fijalkowska I,Medler TR,Skirball J,Cruz P,Zhen L,et al。 α-1抗胰蛋白酶抑制caspase-3活性,阻止肺内皮细胞凋亡。美国病理学杂志。2006; 169(4):1155-66。[ PMC免费文章 ] [ PubMed ] [ Google学术搜索 ]
76. Ando Y. [ Transthyretin:它的奇迹功能和发病机制 ]。Rinsho byori日本临床病理学杂志。2009年; 57(3):228-35。Epub 2009/04/15。。[ PubMed ] [ Google学术搜索 ]
77. Dominguez R,Holmes KC。肌动蛋白的结构和功能。生物物理学年度回顾。2011; 40:169-86。10.1146 / annurev-biophys-042910-155359 [ PMC免费文章 ] [ PubMed ] [ CrossRef ] [ Google学术搜索 ]
78. Toninello A,Pietrangeli P,De Marchi U,Salvi M,Mondovi B. 胺氧化酶在细胞凋亡和癌症中的作用。Biochimica et biophysica acta。2006; 1765(1):1-13。10.1016 / j.bbcan.2005.09.001。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
79. Hogquist KA,Nett MA,Unanue ER,Chaplin DD。白细胞介素1在细胞凋亡过程中被加工和释放。美利坚合众国国家科学院院刊。1991; 88(19):8485-9。 [ PMC免费文章 ] [ PubMed ] [ Google学术搜索 ]
80. Vincent C,Pruliere G,Pajot-Augy E,Campion E,Garnier V,Renard JP。低温保护剂对单细胞兔胚胎冷冻保存过程中肌动蛋白丝的影响。低温生物学。1990; 27(1):9-23。。[ PubMed ] [ Google学术搜索 ]
81. Yamaguchi M. regucalcin在维持细胞稳态和功能中的作用(综述)。国际分子医学杂志。2005; 15(3):371-89。。[ PubMed ] [ Google学术搜索 ]
82. Sariozkan S,Tuncer PB,Buyukleblebici S,Bucak MN,Canturk F,Eken A. 半胱胺,透明质酸和胎球蛋白对布朗瑞士公牛的解冻后精液质量,DNA完整性和氧化应激参数的抗氧化作用。男科学家。2015年; 47(2):138-47。10.1111 /和12236。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
83. Han SW,Roman J. Fibronectin诱导细胞增殖并抑制人支气管上皮细胞的凋亡:由PI3-激酶和NF-κB介导的促癌基因作用。致癌基因。2006; 25(31):4341-9。10.1038 / sj.onc.1209460。[ PubMed] [ CrossRef ] [ Google学术搜索 ]
84. Glander HJ,Herrmann K,Haustein UF。赤道纤维连接蛋白带(EFB)对人类精子的影响 - 对男性生育能力的诊断帮助? 男科学家。1987; 19(4):456-9。。[ PubMed ] [ Google学术搜索 ]
85. Hook VY,Hwang SR。新型分泌小泡serpins,内皮素1和内皮素2:具有不同靶蛋白酶特异性的内源性蛋白酶抑制剂。生物化学。2002; 383(7-8):1067-74。10.1515 / BC.2002.115。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
86. De Souza EM,Meuser-Batista M,Batista DG,Duarte BB,Araujo-Jorge TC,Soeiro MN。Trypanosoma cruzi:α-2-巨球蛋白在体外调节由寄生虫感染诱导的宿主细胞凋亡。实验寄生虫学。2008; 118(3):331-7。10.1016 / j.exppara.2007.09.004。[ PubMed ] [ CrossRef ] [ Google学术搜索 ]
 上海传秋生物科技有限公司
上海传秋生物科技有限公司
沪公网安备 31011402008568号
沪ICP备18030131号-1