 产品说明(可下载)
产品说明(可下载)
大鼠白细胞介素1β定量分析酶联免疫检测试剂盒
本试剂盒仅供科研使用。用于体外定量检测大鼠血清、血浆或细胞培养上清液中的IL-1β浓度。使用前请仔细阅读说明书并检查试剂组分是否完整,如有产品包装破损或质量投拆,请在收到货一个月之内联系我们。
IL-1β简介:
白介素-1又称淋巴细胞激活因子,由 IL-1α和 IL-1β两种形式的多肽类细胞因子构成,与许多的细胞活性相关,包括增殖、分化以及凋亡, 主要由血液中的单核细胞和巨噬细胞所产生, 各种上皮细胞,内皮细胞和间质细胞也能产生IL-1, 但血液中的IL-1 主要是由单核细胞和巨噬细胞所产生的IL-1β。
由激活巨噬细胞产生的IL-1β,经蛋白酶-1酶解活化后,成熟的白介素-1分子可以诱导白介素-2的释放、促进B细胞成熟与增殖、诱导成纤维细胞生长因子活性,通过这些影响可以刺激胸腺细胞增殖,进而影响机体的免疫反应。研究表明白介素-1蛋白与炎症初始反应相关,起到调节因子的作用,通常被认为是内源性致热原;细菌的内毒素或者一些非细菌的炎症因子都会诱导IL‐1产生,然后被释放到局部组织,IL-1β含量升高表明机体内有组织损伤或者感染产生, 如败血症等。对IL-1β的研究主要集中在各种生理和病理免疫反应和炎症反应过程领域。
检测原理:
本试剂盒采用双抗体夹心ELISA法检测样本中大鼠IL-1β的浓度。大鼠IL-1β捕获抗体已预包被于酶标板上,当加入标本或参考品时,其中的大鼠IL-1β会与捕获抗体结合,其它游离的成分通过洗涤的过程被除去。当加入生物素化的抗大鼠IL-1β抗体后,抗大鼠IL-1β抗体与大鼠IL-1β接合,形成夹心的免疫复合物,其它游离的成分通过洗涤的过程被除去。随后加入辣根过氧化物酶标记的亲合素。生物素与亲合素特异性结合,亲合素连接的酶就会与夹心的免疫复合物连接起来;其它游离的成分通过洗涤的过程被除去。最后加入显色剂,若样本中存在IL-1β将会形成免疫复合物,辣根过氧化物酶会催化无色的显色剂氧化成蓝色物质,在加入终止液后呈黄色。通过酶标仪检测,读其450nm处的OD值,大鼠IL-1β浓度与OD450值之间呈正比,通过参考品绘制标准曲线,对照未知样本中OD值,即可算出标本中IL-1β浓度。
大鼠IL-1β定量分析酶联免疫检测试剂盒组成:
组分 | 规格(96T/48T) |
大鼠IL-1β预包被板 | 12条/6条 |
样本分析缓冲液 | 5ml/3ml |
标准品稀释液 | 10ml/5ml |
大鼠IL-1β标准品 | 4支/2支(冻干) |
大鼠IL-1β生物素化抗体 | 10ml/5ml |
亲和素连接的HRP酶 | 10ml/5ml |
浓缩洗涤液 20× | 30ml/15ml |
TMB底物 | 10ml/5ml |
中止液 | 5ml/3ml |
封板胶纸 | 3/2张 |
说明书 | 1份 |
标本收集:
1.标本的收集请按下列流程进行操作;
A.细胞上清标本离心去除悬浮物后即可;
B.血清标本应是自然凝固后,取上清,避免在冰箱中凝固血液;
C.血浆标本,推荐用EDTA的方法收集;
D.若待测样本不能及时检测,标本收集后请分装,冻存于-20℃,避免反复冻融。
2.血清标本不应添加任何防腐剂或抗凝剂;
3.标本应清澈透明,检测前样本中如有悬浮物应通过离心去除。
4.请勿使用溶血,高血脂或污染的标本检测,否则结果将不准确。
注:大鼠血清或血浆样本请用样本分析缓冲液做倍比稀释后再检测。
注意事项:
1.试剂盒请保存在2~8℃。
2.浓缩洗涤液因在低温下可能有结晶,请水浴加热使结晶完全溶解后再配制工作液。
3.标准品复溶加样后,剩余部份请丢弃。
4.底物请勿接触氧化剂和金属。
5.加样时,请及时更换枪头,避免交叉污染。
6.严禁混用不同批号的试剂盒组份。
7.充分混匀对保证反应结果的准性很重要,在加液后请轻轻叩击边缘以保证混匀。
8.室温反应,请严格控制在25~28℃。
9.洗涤过程是至关重要的,洗涤不充分会使精确度下降并导致结果误差较大。
10.试验中标准品和样本检测时建议作双复孔。
11.加样过程中避免气泡的产生。
12.血清和血浆标本的检测时,检测抗体的孵育时间应适当延长。
检测前准备工作:
1.试剂盒自冰箱中取出后应置室温(25~28℃)平衡20分钟;每次检测后剩余试剂请及时于2~8℃保存。
2.将浓缩洗涤液用双蒸水或去离子水稀释(1份加19份水)。
3.如有5X准品稀释液,请按所需量用双蒸水或去离子水稀释(1份加4水)。
4.标准品: 按标签复溶体积加入标准品稀释液复溶使大鼠IL-1β终浓度达到4000pg/ml,室温反应,请严格控制在25~28℃,静置10~15分钟后轻轻混悬(建议抽吸几次)待彻底溶解,用标准品稀释液倍比梯度稀释后依次加入检测孔中。(标准曲线取七个点,最高浓度为4000pg/m l,标准品稀释液直接加入作为0浓度)。
洗涤方法:
自动洗板机或人工洗板:每孔洗涤液为300ul,注入与吸出间隔15-30秒。洗板5次。最后一次洗板完成后将板倒扣着在厚吸水纸上用力拍干。
实验过程需自备的材料:
1.不同规格的加样枪及相应的枪头;
2.酶标仪;
3.自动洗板机;
4.去离子水或双蒸水;
操作步骤:
1.通过计算并确定一次性实验所需的板条数,取出所需板条放置在框架内,暂时用不到板条请放回铝箔袋密封,保存于4℃。
2.建议设置本底较正孔,即空白孔设置方法为该孔只加TMB显色液和中止液。每次实验均需做标准品对照并画出标准曲线。
3.分别将标本或不同浓度标准品(100ul/孔)加入相应孔中,用封板胶纸封住反应孔,室温(25~28℃)孵育120分钟。对于血清或血浆标本,请加入50ul样本分析缓冲液后加50ul标本,如稀释量大,请将样本与样本分析缓冲液等量加入,不足部分用标准品稀释液补充至100ul。
4.洗板5次,且最后一次置厚吸水纸上拍干。
5.加入生物素化抗体工作液(100ul/孔)。用封板胶纸封住反应孔,室温(25~28℃)孵育60分钟。
6.洗板5次,且最后一次置厚吸水纸上拍干。
7.加入亲和素链接的HRP酶工作液(100ul/孔)。用封板胶纸封住反应孔,避光室温(25~28℃)孵育20分钟。
8.洗板5次,且最后一次置厚吸水纸上拍干。
9.加入显色剂TMB100ul/孔,避光室温(25~28℃)孵育20分钟。
10.加入终止液50ul/孔,混匀后即刻测量OD450值。
结果判断:
1.复孔的值在20%的差异范围内结果才有效,复孔的值平均后可作为测量值。
2.每个标准品或标本的OD值应减去本底校正孔的OD值。
3.手工绘制标准曲线。以标准品浓度作横坐标,OD值作纵坐标,以平滑线连接各标准品的坐标点。通过标本的OD值可在标准曲线上查出其浓度。
4.若标本OD值高于标准曲线上限,应适当稀释后重测,计算浓度时应乘以稀释倍数。
典型数值和参考曲线
浓度pg/ml | 典型OD值1 | 典型OD值2 | OD平均值 |
0 | 0.1889 | 0.2101 | 0.1995 |
125 | 0.3002 | 0.278 | 0.2891 |
250 | 0.3716 | 0.3894 | 0.3805 |
500 | 0.5991 | 0.5457 | 0.5724 |
1000 | 0.9467 | 0.9903 | 0.9685 |
2000 | 1.4113 | 1.4297 | 1.4205 |
4000 | 2.0125 | 1.9505 | 1.9815 |
大鼠IL-1β参考标准曲线
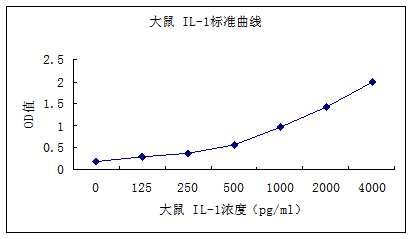
注意:本图仅供参考,应以同次试验标准品所绘标准曲线计算标本含量。
灵敏度,特异性和重复性:
1.灵敏度:多次重复结果表明,最小检出量为42.5pg/ml。
2.特异性:与GDNF,GM-CSF,IFN-γ,IL-1 R6, PDGF-BB,TNF-α,VEGF等没有交叉反应。
3.重复性:板内,板间变异系数均<10%.
参考文献:
1. Nickel, W. (2003) Eur. J. Biochem. 270:2109.
2. Beuscher, H.U. et al. (1988) J. Biol. Chem. 263:4023.
3. Pollock, A.S. et al. (2003) FASEB J. 17:203.
4. Dinarello, C.A. (1996) Blood 87:2095.
5. Leong, S.R. et al. (1988) Nucleic Acids Res. 16:9053.
 上海传秋生物科技有限公司
上海传秋生物科技有限公司
沪公网安备 31011402008568号
沪ICP备18030131号-1